電子式を書く手順
下の問題が全て解けるか確認してみましょう
(1)H₂O (2)CO₂ (3)N₂ (4)SO₂ (5)O₂ (6)H₂S (7)NO₂
原則
①各原子の最外殻電子数を数えて足す
②外側の原子から閉殻(オクテット)になるように埋める
例:NH₃
問)NH₃の電子式を書け
①Nの最外殻電子は5つ、Hの最外殻電子は1つだからNH₃の最外殻電子数は5+1×3=8
※原子の最外殻電子数は周期表の族の1の位と一致する。Nは15族、Hは1族。
②Hは電子2つで閉殻、Nは電子8つで閉殻となることを意識。まず外側の原子であるHに2つずつ電子を埋める。余った2つをNに埋めればNも電子8つをもって閉殻になっていることが分かる。


基本的にHは電子2つで閉殻、その他の原子は電子8つで閉殻と考える場合が多い。電子式を書いた後にそれぞれの原子がちゃんと閉殻になっているか確認するようにしたい。
問題演習
(1)H₂O (2)CO₂ (3)N₂ (4)SO₂ (5)O₂ (6)H₂S (7)NO₂
H₂O
(1)①最外殻電子数は1×2+6=8
②
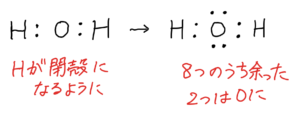 構造式はH-O-H
構造式はH-O-H
CO₂
(2)①最外殻電子数は4+6×2=16
②
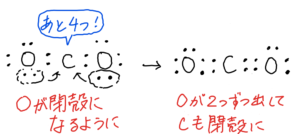 構造式はO=C=O
構造式はO=C=O
N₂
(3)①最外殻電子数は5×2=10
②
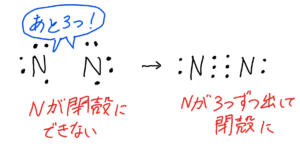 構造式はN≡N
構造式はN≡N
SO₂
(4)①最外殻電子数は6+6×2=18
②
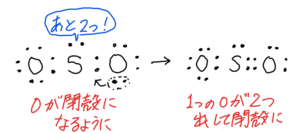 構造式はOーS=O
構造式はOーS=O
O₂
(5)①最外殻電子数は6×2=12
②
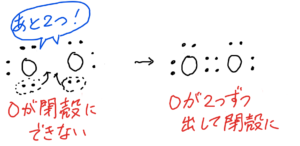 構造式はO=O
構造式はO=O
H₂S
(6)①最外殻電子数は1×2+6=8
②
 構造式はH-S-H
構造式はH-S-H
NO₂
(7)①最外殻電子数は5+6×2=17
②
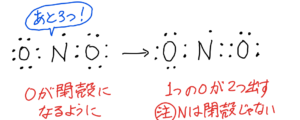 構造式はO-N=O
構造式はO-N=O
参考
電子式の作り方を考え直すと、(1)H₂Oと(6)H₂Sの電子式や構造式がOとSを入れ替えただけになっている理由がわかるだろう。SとOはどちらも16族であり、最外殻電子数が共通だからである(どちらも6)
→つまりSO₂の電子式が書ければSをOに置き換えたO₃(オゾン)の電子式も書けたも同然ということだ。見たことのない物質の電子式が問われても、書ける物質の電子式を活かすことができれば応用に対応することができる。




コメント