酸・塩基に関する化学反応式
下の問題が全て解けるか確認してみましょう
(2)H₂SO₄+NaOH→?
(3)CO₂+NaOH→?
(4)HCl+Na₂CO₃→?
(5)HCl+NaHCO₃→?
ここでは酸・塩基に関する化学反応式のうち原理原則で書ける範囲のものを扱う(暗記する必要のあるものは別の記事で扱う)
前提知識① H⁺を出すのが酸、受け取るのが塩基
H⁺を出すのが酸、受け取るのが塩基。酸・塩基の最もシンプルな定義はこれである。
前提知識② 酸がH⁺を出せば塩基に、塩基がH⁺を受け取れば酸に
酢酸CH₃COOHが酸であることを知っている人は多いが、酢酸が水素イオンを放出した形である酢酸イオンCH₃COO⁻が塩基であると認識している人は少ない。
同様にアンモニアNH₃が塩基であることを知っている人は多いが、アンモニアが水素イオンを受け取った形であるアンモニウムイオンNH₄⁺が酸であると認識している人は少ない。

酸はH⁺を放出した後、塩基になる
塩基はH⁺を受け取った後、酸になる
共役酸・共役塩基の図
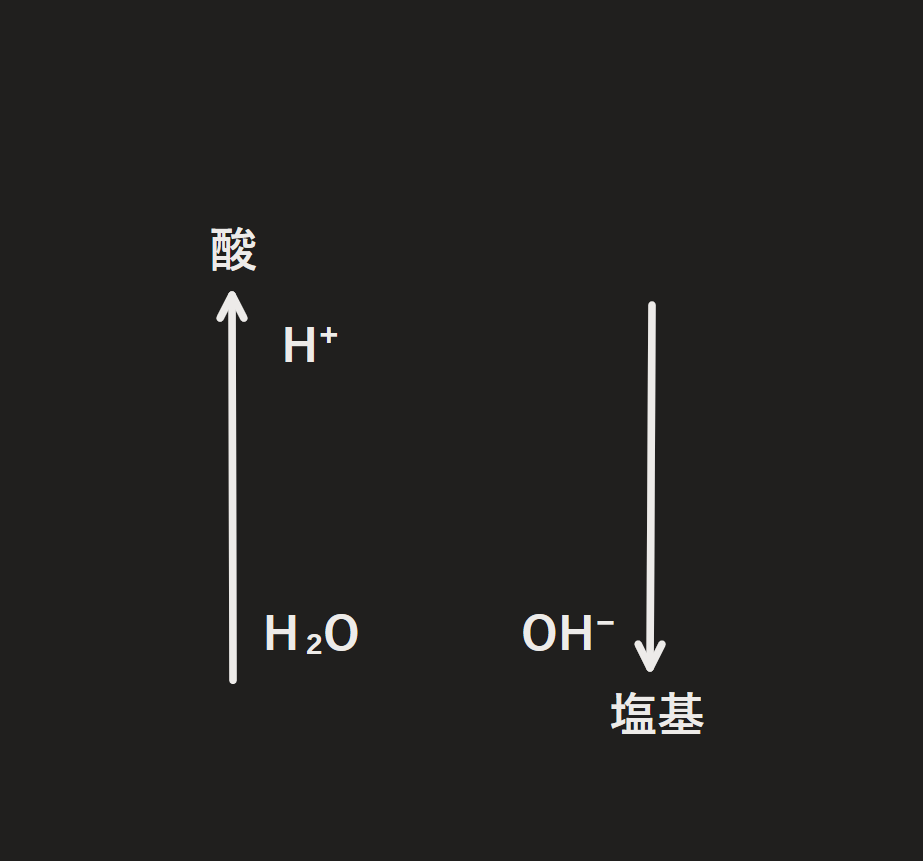
↑この図を描いて考えることで酸・塩基の化学反応式は飛躍的に書きやすくなる
図の意味
・矢印の先が強い酸・塩基であり、矢印の根元が弱い酸・塩基
・酸からH⁺を出したものを右真横に書く(塩基にH⁺を足したものを左真横に書く)
・基本的には強い酸・塩基同士が反応するため右下方向の反応が起きる
図の使い方
例)HCl+NaOH→?
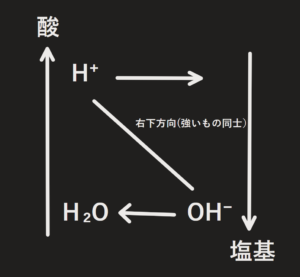
HClは酸、NaOHは塩基であるためそれぞれを図に書き込むが、Cl⁻とNa⁺は中和の本質部分ではないので省略して書く。
そうすると本質となる式はH⁺+OH⁻→H₂Oである

H⁺とOH⁻が反応することでH⁺はなくなり、OH⁻はH₂Oに変わるというイメージ
両辺にNa⁺とCl⁻を足して
HCl+NaOH→H₂O+NaCl
問題演習
今まで丸暗記で答えていた反応式や簡単だと感じる反応式も、共役酸・共役塩基の図を描いて式が書けるか確かめてほしい。
(2)H₂SO₄+NaOH→?
(3)CO₂+NaOH→?
(4)HCl+Na₂CO₃→?
(5)HCl+NaHCO₃→?
(1)CH₃COOHは酸、NaOHは塩基。図からCH₃COOH+OH⁻→CH₃COO⁻+H₂O
両辺にNa⁺を足してCH₃COOH+NaOH→CH₃COONa+H₂O
(2)H₂SO₄は酸、NaOHは塩基。図からH⁺+OH⁻→H₂O
硫酸はHを2つ持つので両辺を2倍し2H⁺+2OH⁻→2H₂O
両辺にSO₄²⁻とNa⁺を足してH₂SO₄+2NaOH→2H₂O+Na₂SO₄
(3)Point:CO₂に関する中和の反応式を作るときはH₂O+CO₂(H₂CO₃)で考える
H₂CO₃は酸、NaOHは塩基。図からH₂CO₃+OH⁻→HCO₃⁻+H₂O
また生成したHCO₃⁻は酸でも塩基でもあるので図からHCO₃⁻+OH⁻→CO₃²⁻+H₂O
式を辺々足してH₂CO₃+2OH⁻→CO₃²⁻+2H₂O
両辺にNa⁺を足してH₂CO₃+2NaOH→Na₂CO₃+2H₂O
H₂CO₃はH₂O+CO₂であるため両辺のH₂Oが1つ消えてCO₂+2NaOH→Na₂CO₃+H₂O
(4)HClは酸、Na₂CO₃は塩基。図からH⁺+CO₃²⁻→HCO₃⁻
また生成したHCO₃⁻は酸でも塩基でもあるので図からHCO₃⁻+H⁺→H₂CO₃
式を辺々足して2H⁺+CO₃²⁻→H₂CO₃
両辺にCl⁻とNa⁺を足して2HCl+Na₂CO₃→H₂CO₃+2NaCl
(5)HClは酸、NaHCO₃は塩基(HCO₃⁻は酸でも塩基でもあるため、反応する物質を見てどちらか決める)図からH⁺+HCO₃⁻→H₂CO₃
両辺にCl⁻とNa⁺を足してHCl+NaHCO₃→H₂CO₃+NaCl




コメント